Buenas tardes, abro este hilo para hablar sobre este tema, que es algo que siempre me ha resultado curioso y aunque tengo mi idea, me gustaría preguntar sobre el tema a gente que habrá reflexionado mucho más sobre ello y lo conocerá mejor:
Es un tema que viene a relación del funcionamiento que a priori cuesta entender de como se enfrían sustancias al reducir su presión (o al revés, se calientan al aumentar su presión). Aún muchos ejemplos en los que se da (como un propio aerosol), pero yo creo que la forma mas clara de plantearlo es como el típico esquema frigorífico:
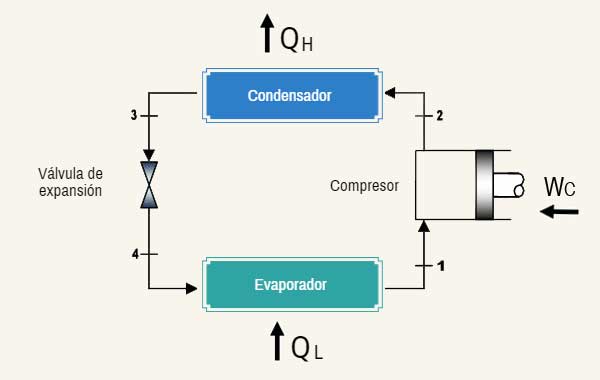
Se puede hablar mucho de esto, pero a lo que yo voy es el paso de 3 a 4. Ss decir en el punto 3 tenemos una sustancia con una energía calorífica, una temperatura, y una presión, y en cambio en el punto 4, tenemos la misma sustancia con la misma energía calorífica, pero menos presión y menos temperatura. Básicamente lo único que ha pasado es de estar en un sitio mas estrecho (3), a uno mas amplio (4), y por tanto su presión baja, eso es obvio, pero lo de la temperatura manteniendo la misma energía ya me cuesta un poco más.
Mi idea es que al estar a mas presión, hay menos espacio y por tanto "rebotan" mas las moléculas y por tanto van mas aceleradas (mas temperatura), y al bajar la presión pasa lo contrario, pero me cuesta que cuadre el concepto de la misma sustancia misma energía diferente temperatura, supongo que porque uno tiende a dejar fuera de la ecuación la presión, pero era a ver si podíais arrogar algo de luz a este tema que siempre me ha resultado cuanto menos curioso.
